¿Por qué envejecemos?
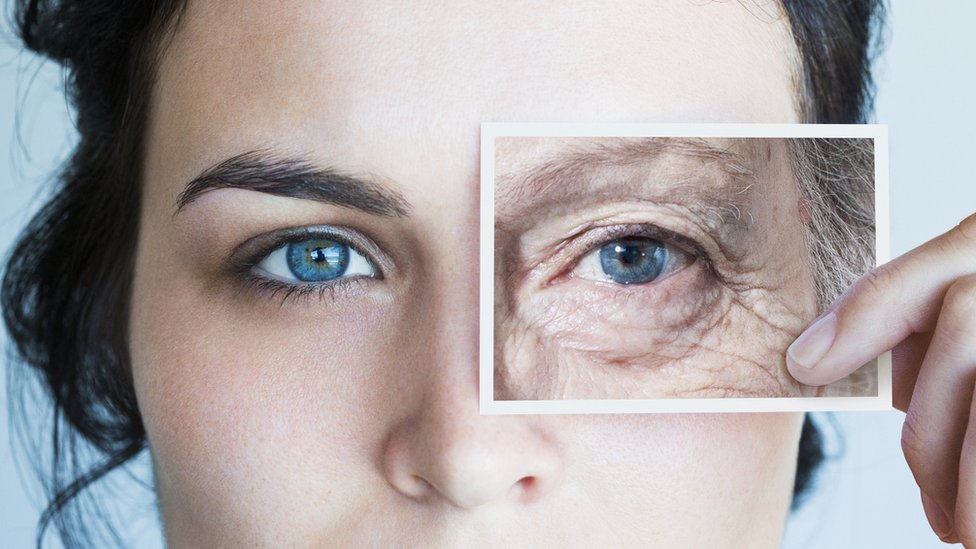
Estos son los 9 sellos del envejecimiento y así trabajan los científicos obsesionados para revertir el reloj
La investigación de los mecanismos que están detrás del envejecimiento está revolucionando la búsqueda de tratamientos para la longevidad
The Wall Street Journal

0ESCUCHAR
NUEVA YORK.– Los científicos obsesionados con el envejecimiento están logrando dibujar la hoja de ruta de los cambios que experimentan nuestros cuerpos a medida que envejecemos, con la esperanza de que esto conduzca al desarrollo de tratamientos que nos ayuden a vivir más años y en salud.
Esa hoja de ruta está marcada por “claves” o “sellos” del envejecimiento, un conjunto de marcadores y mecanismos biológicos vinculados a nuestra inexorable camino hacia la muerte. Durante la última década, por ejemplo, el descubrimiento de esos marcadores biológicos contribuyó al desarrollo de medicamentos que eliminan las células que dejaron de dividirse, y terapias genéticas que parecen restaurar la juventud de ciertas células.
En un artículo de 2013 en la revista Cell, ampliamente citado en el campo del envejecimiento, los científicos europeos codificaron nueve claves de envejecimiento, entre ellas, el desgaste de los telómeros —los segmentos de ADN que están en los extremos de los cromosomas—, la senescencia celular —cuando las células dejan de dividirse—, y fallas en la detección de los nutrientes.
Esos marcadores o sellos distintivos parecen manifestarse con la edad, y cuando se potencian, el envejecimiento se acelera. A su vez, están interconectados de formas que los investigadores todavía no terminan de entender. Según algunos científicos, esa interacción podría ser la clave de por qué envejecemos.
Los científicos están cada vez más cerca de resolver misterios que desconciertan a la humanidad desde la noche de los tiempos. Gilgamesh, protagonista del poema épico grabado en tablillas de arcilla hace 4000 años, estaba obsesionado con derrotar a la mortalidad, y el emperador chino Qin Shi-Huang, muerto en el año 210 a.C., bebió mercurio con la esperanza de burlar a la muerte.
“El envejecimiento siempre ha despertado la imaginación de la humanidad, pero recién en los últimos tiempos ha sido tema de un profundo análisis científico”, dice Carlos López-Otin, bioquímico de la Universidad de Oviedo, España, uno de los coautores del artículo sobre las 9 claves del envejecimiento.
Una característica que llama la atención son las alteraciones en el epigenoma, que son los compuestos químicos y proteínas que pueden unirse al ADN y activar o desactivar ciertos genes. Algunos investigadores creen que una acumulación de fallas en el epigenoma impulsa el envejecimiento y que eliminar esas fallas mediante un “reprogramación” de las células podría alargar la vida.
Shinya Yamanaka, investigador japonés de células madre, compartió el Premio Nobel de Medicina de 2012 por el descubrimiento de proteínas que reprograman el epigenoma de una célula hasta devolverlo a su estado embrionario.
Los científicos han utilizado las proteínas para prolongar la vida útil en ratones y revertir la ceguera en ratones y monos. Y hay empresas de biotecnología como Altos Labs, Retro Biosciences y Calico Life Sciences —una división de Alphabet, empresa matriz de Google—, que están investigando si la reprogramación celular puede extender la esperanza de vida o mejorar la salud humana.
Dorian Therapeutics y Senolytic Therapeutics están desarrollando fármacos que erradican o previenen la formación de células senescentes —otras de las 9 claves— para comprobar si eso frena el envejecimiento y mitiga las enfermedades relacionadas con la edad.
Vías de detección de nutrientes
Otros científicos están experimentando con fármacos dirigidos a una característica llamada “vías de detección de nutrientes”, sensores que las células usan para reconocer fuentes de combustible, como azúcares y proteínas. Con el avance de la edad, esos sensores se vuelven menos efectivos y su deterioro se ha relacionado con innumerables problemas de salud, incluidos trastornos metabólicos y cáncer.
Las restricciones dietarias afectan esas vías de detección de nutrientes, y eso, según las investigaciones, puede fomentar la longevidad. Los estudios han demostrado que las dietas reducidas en calorías aumentan la esperanza de vida y mejoran la salud. Una teoría es que la restricción calórica estresa las células y aumenta su resiliencia.
Algunos fármacos, incluida la rapamicina, que parecen imitar los efectos de la restricción calórica, han aumentado la esperanza de vida en ratones. Los receptores de trasplantes de órganos suelen tomar rapamicina, que bloquea un tipo de sensor de nutrientes, para suprimir la respuesta inmunitaria.
El Dog Aging Project, con sede en la Universidad de Washington, está probando si la rapamicina puede prolongar la vida útil de los perros. Y al empresa AgelessRx y los investigadores de la Universidad de Columbia son algunos de los equipos que están ayudando a desarrollar ensayos clínicos para probar el potencial antienvejecimiento de la rapamicina en personas.
Una teoría popular que surgió en el siglo pasado sostenía que otro sello distintivo, los telómeros, podrían contener una milagrosa solución contra el envejecimiento. En 2009, ganaron el Premio Nobel los investigadores que descubrieron la naturaleza molecular de los telómeros y la telomerasa, una enzima que puede mantener o extender su longitud.
Los telómeros se acortan a medida que envejecemos, y los estudios muestran que los telómeros cortos parecen estar vinculados con el desarrollo de enfermedades. Pero eso no quiere decir que extender los telómeros necesariamente alargaría la vida. La activación de la telomerasa, por ejemplo, podría provocar una replicación descontrolada de las células cancerosas. Y según un estudio publicado en mayo en el New England Journal of Medicine, las personas con telómeros inusualmente largos tienen mayor riesgo de desarrollar tumores y trastornos sanguíneos.
De todos modos, algunos investigadores y empresas, como Telomere Therapeutics y Geron, están manipulando los telómeros en un intento de encontrar nuevos tratamientos para el cáncer y otros trastornos relacionados con la edad.
Los investigadores del envejecimiento dicen que las nueve claves los ayudaron a darle forma a una visión compartida de todo su campo de estudio. Pero si bien esas claves describen lo que sucede durante el envejecimiento, no explican por qué esos cambios ocurren, apunta David Gems, genetista del University College de Londres.
A principios de este año, el grupo que publicó las nueve claves originales agregó tres más, en base a investigaciones posteriores: la disbiosis —desequilibrio en el microbioma de organismos que viven en nuestro cuerpo—; las fallas en la autofagia —la capacidad de una célula para reciclar partes dañadas de sí misma—, y el “inflammaging”, o sea el envejecimiento por inflamación crónica.
Probablemente surgirán más marcadores distintivas y otros serán descartadas o combinadas a medida que avance la investigación, señala el genetista danés Lene Juel Rasmussen.
“Las características distintivas son dinámicas”, apunta Rasmussen.
Estos son los 9 “sellos” del envejecimiento
Estos son algunos de los cambios biológicos claves identificados por los investigadores que parecen ocurrir con el avance de la edad.
- Inestabilidad genómica: con el paso del tiempo, el daño en el ADN se traduce en una acumulación de mutaciones en el genoma.
- Desgaste de los telómeros: se ha descubierto que las estructuras protectoras de los extremos de los cromosomas, llamadas telómeros, se acortan a medida que envejecemos.
- Alteraciones epigenéticas: los procesos que regulan si los genes se activan o desactivan pueden cambiar con el tiempo.
- Pérdida de proteostasis: se deteriora la maquinaria de las células que controla la síntesis, el mantenimiento y la limpieza de proteínas.
- Detección desregulada de nutrientes: los sensores que utilizan las células para regular las fuentes de combustible, como la glucosa, se vuelven menos efectivos.
- Disfunción mitocondrial: las mitocondrias —las usinas de energía de las células— pueden dañarse y volverse disfuncionales.
- Senescencia celular: a medida que envejecemos, las células que dejan de dividirse pero no mueren empiezan a acumularse.
- Agotamiento de las células madre: las células madre, que pueden convertirse en muchos tipos de células y servir como sistemas de reparación corporal, pierden su poder regenerativo y otras de sus funciones.
- Comunicación intercelular alterada: las células pueden perder la capacidad de comunicarse adecuadamente entre ellas.
(Traducción de Jaime Arrambide)
Por Dominique MosbergenThe Wall Street Journal
Fuente: La Nación





